《2022年高考化學(xué)一輪復(fù)習(xí)《鋁的化合物》學(xué)案》由會(huì)員分享����,可在線閱讀,更多相關(guān)《2022年高考化學(xué)一輪復(fù)習(xí)《鋁的化合物》學(xué)案(3頁(yè)珍藏版)》請(qǐng)?jiān)谘b配圖網(wǎng)上搜索��。
1、2022年高考化學(xué)一輪復(fù)習(xí)《鋁的化合物》學(xué)案
【學(xué)習(xí)目標(biāo)】1�����、記住氧化鋁��、氫氧化鋁的物理性質(zhì)����、化學(xué)性質(zhì)、制備���、用途�����。
2�����、理解氧化鋁����、氫氧化鋁的兩性��。 3、熟記鋁三角的轉(zhuǎn)化
【重點(diǎn)難點(diǎn)】
重點(diǎn) :氧化鋁��、氫氧化鋁的兩性�����。
難點(diǎn) : 鋁三角的轉(zhuǎn)化
【使用說明及學(xué)法指導(dǎo)】
1���、完成預(yù)習(xí)案��,形成鋁三角完整的知識(shí)體系��。
2、重點(diǎn)理解鋁三角轉(zhuǎn)化中對(duì)物質(zhì)的要求和有關(guān)量的計(jì)算
預(yù)習(xí)案
一���、 知識(shí)梳理
化學(xué)式
Al2O3
Al(OH)3
屬類
兩性氧化物
兩性氫氧化物
顏色狀態(tài)
白色固體���,天然產(chǎn)稱為剛玉(紅寶石、藍(lán)寶石)
白色膠狀沉淀
溶解性
難溶
難溶
熱穩(wěn)定
2�����、性
穩(wěn)定
加熱分解為氧化物化和水
與酸反應(yīng)
Al2O3 + 6H+ == 2Al3+ + 3H2O
Al(OH)3+ 3H+ == Al3+ + 3H2O
與強(qiáng)堿反應(yīng)
Al2O3 + 2NaOH == 2NaAlO2 + H2O
Al(OH)3 + NaOH == NaAlO2 + 2H2O
制備方法
2Al(OH)3 Al2O3 + 3H2O
Al3+ + 3NH3·H2O == Al(OH)3 ↓+ 3NH4+
2AlO2 — + CO2 +3H2O == 2Al(OH)3↓ + HCO32—
Al3+ + 2AlO2 — + 3H2O == 2Al(OH)
3�����、3↓
氧化鋁、氫氧化鋁的用途:
二�、總結(jié)整理及自測(cè)
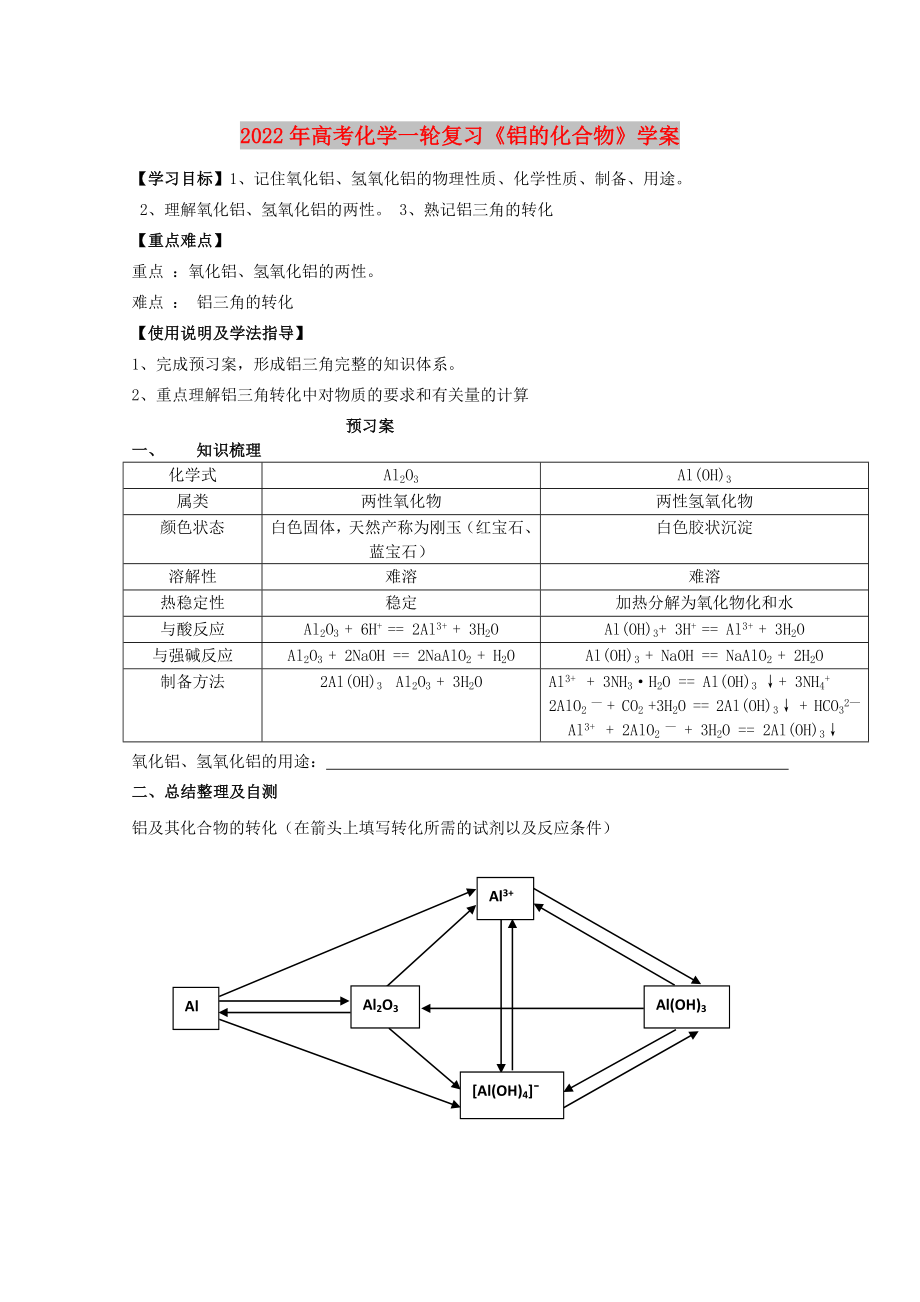
鋁及其化合物的轉(zhuǎn)化(在箭頭上填寫轉(zhuǎn)化所需的試劑以及反應(yīng)條件)
Al3+
Al
Al(OH)3
Al2O3
[Al(OH)4]ˉ
Al3+
Al
Al(OH)3
Al2O3
[Al(OH)4]ˉ
探究案
合作探究:
1、現(xiàn)有一塊已知質(zhì)量為56.4g的鋁鎂合金��,欲測(cè)定其中鎂的質(zhì)量分?jǐn)?shù)�����,兩位同學(xué)設(shè)計(jì)了不同的實(shí)驗(yàn)方案���。
足量鹽酸
實(shí)驗(yàn)設(shè)計(jì)1:鋁
4���、鎂合金 測(cè)定生成氣體的體積為69.44L(標(biāo)準(zhǔn)狀況)
①足量鹽酸
②過量NaOH溶液
實(shí)驗(yàn)設(shè)計(jì)2:鋁鎂合金 過濾,測(cè)定沉淀的質(zhì)量為5.8g
(1)寫出實(shí)驗(yàn)方案2中反應(yīng)②的離子方程式
________________________________________________________________________________
(2)實(shí)驗(yàn)方案1中鎂的質(zhì)量分
5���、數(shù)為
(3)請(qǐng)你設(shè)計(jì)第三種測(cè)定鎂的質(zhì)量分?jǐn)?shù)的實(shí)驗(yàn)方案(表示方式同上)
2��、向氯化鋁溶液中滴加氨水至過量�,現(xiàn)象是________________________;向氯化鋁溶液中滴加氫氧化鈉溶液至過量��,現(xiàn)象是______________________n[Al(OH)3]
)
n(NH3·H2O)
n[Al(OH)3]
)
n(NaOH)
______________________
6�、_ ����。
若氯化鋁的物質(zhì)的量為1mol�,在下列坐標(biāo)系中畫出相應(yīng)的
3、工業(yè)上用鋁土礦(主要成分Al2O3���、Fe2O3�����、SiO2)提取氧化鋁作冶煉鋁的原料���,提取的操作過程如下:
Al2O3
Al(OH)3
濾液乙
③通CO2氣體,并控制反應(yīng)條件
濾液甲
沉淀
②加濃NaOH
溶液�,加熱
沉淀
濾液
鋁土礦
過濾
加熱
④過濾
洗滌
過濾
①加鹽酸
7、
(1)寫出步驟②中所發(fā)生反應(yīng)的離子方程式
8�����、
________________________________________________________________________________
(2)用氧化鋁冶煉鋁的化學(xué)方程式是__________________________________________
(3)請(qǐng)?jiān)O(shè)計(jì)另一個(gè)實(shí)驗(yàn)方案提取氧化鋁(表示方式同上)
_________________
9���、__________________
訓(xùn)練案
一、課中訓(xùn)練與檢測(cè):
X物質(zhì)的量
沉淀的量
Y
0
1����、將溶液或氣體X慢慢的加入或通入到一定量的Y溶液中�,Y溶液產(chǎn)生沉淀的量與X的物質(zhì)的量的關(guān)系可以用如圖表示的是 ( )
A.X為NaOH溶液����,Y為AlCl3溶液
B.X為CO2,Y為Ca(OH)2溶液
C.X為NH3���,Y為Al2(SO4)3溶液
D.X為HCl�,Y為Na溶液
2�、以下各組均有三種溶液,這三種溶液中所含溶質(zhì)的物質(zhì)的量均相等��,將它們充分混合后��,不會(huì)產(chǎn)生沉淀的是
A���、AlCl3��、Ba(OH)2�、HCl B��、BaCl2、Na2CO3����、KOH
C、MgCl2��、NaOH����、HNO3 D、Na����、NaOH、H2SO4
二���、課后鞏固促提升:完成《步步高》P60-P61頁(yè)中的習(xí)題�����。
 2022年高考化學(xué)一輪復(fù)習(xí)《鋁的化合物》學(xué)案
2022年高考化學(xué)一輪復(fù)習(xí)《鋁的化合物》學(xué)案